 |
 |
- Search
| Korean J Neuromuscul Disord > Volume 12(2); 2020 > Article |
|
ABSTRACT
Background
Methods
Results
Conclusions
Fig.┬Ā1.
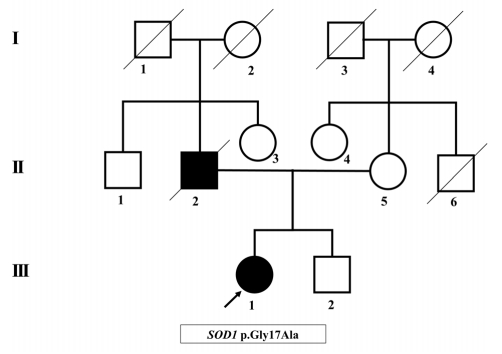
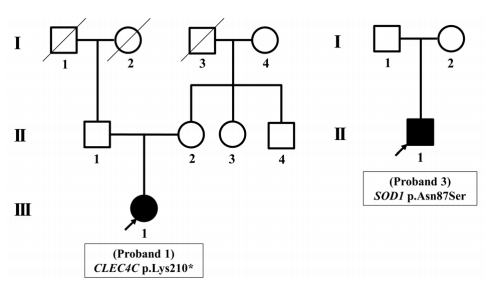
Fig.┬Ā2.
Table┬Ā1.
| Proband No. | Gender | Age of onset (years) | Putative diagnosis before ALS diagnosis | Ēŗ░-Escorial criteria at diagnosis | Region of onset | FVC at 1st visit (%) | Cognitive impairment at 1 st visit | Diagnostic delay (months) | Disease duration at diagnosis (months) | ALSFR S-R at 1st visit | Progression speed at 1st visit (╬öFS) | Follow-up duration (months) | Progression speed from 1 st visit to latest visit | Family history of ALS | Gene | Variants | References |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 19 | BFA | Clinically probable | Upper limb | 68.0 | No | 4 | 20 | 46 | 0.10 | 33 (alive) | 1.12 | No | CLEC4C | p.Lys210* | Lim et al. [19] (2016) |
| 2 | M | 20 | Disuse atrophy | Clinically probable | Lower limb | 83.3 | No | 96 | 96 | 37 | 0.11 | 53 (alive) | 0.38 | No | - | ||
| 3 | M | 21 | Myopathy | Clinically suspected | Lower limb | NA | No | 8 | 9 | 37 | 1.22 | 10 (alive) | 3.40 | No | SOD1 | p.Asn87 Ser | |
| 4 | M | 23 | MND | Clinically definite | Upper limb | 58.0 | Yes (ALScbi) | 12 | 23 | 36 | 0.52 | 60 (alive) | 0.25 | No | - | ||
| 5 | F | 23 | MND | Clinically probable | Upper limb | 74.6 | No | 11 | 47 | 35 | 0.28 | 43 (alive) | 0.09 | No | - | ||
| 6 | M | 24 | MND | Clinically definite | Upper limb | 80.0 | No | 12 | 16 | 43 | 0.31 | 57 (alive) | 0.68 | No | - | ||
| 7 | F | 25 | Lumbar radiculop athy | Clinically suspected | Lower limb | 96.0 | No | 8 | 10 | 43 | 0.50 | 49 (alive) | 0.69 | Yes | SOD1 | p.Gly17A la |
ALS, amyotrophic lateral sclerosis; BFA, benign focal amyotrophy; MND, motor neuron disease; FVC, functional vital capacity; ALSFRS-R, amyotrophic lateral sclerosis functional rating scale - revised; ALScbi, ALS with combined cognitive and behavioural impairment; ╬öFS, progression speed=(48-ALSFRS-R at ŌĆ£time of 1st visitŌĆØ)/duration from onset to 1st visit (months); progression speed from 1st visit to latest visit=(ALSFRS-R at ŌĆ£time of 1st visit-ALSFRS-R at ŌĆ£latest visitŌĆØ)/disease duration from 1st visit).
REFERENCES
-
METRICS

-
- 1 Crossref
- Scopus
- 3,390 View
- 66 Download
- Related articles in Korean J Neuromuscul Disord
-
Clinical Characteristics of Korean Juvenile Amyotrophic Lateral Sclerosis2020 ;0(0)
Cognitive and Behavioral Impairment in Amyotrophic Lateral Sclerosis2015 June;7(1)
Clinical Features and Clinical Variants of Amyotrophic Lateral Sclerosis2014 December;6(2)





